Era dos Exossomos e sua Aplicação Terapêutica
Tecnologia com grande futuro no gerenciamento do envelhecimento facial!
Os exossomos, pequenas vesículas extracelulares, foram inicialmente descobertos na década de 1940, mas apenas ganharam atenção significativa no meio dos anos 2000 como mediadores na comunicação entre células. Atualmente, estamos no início da era dos exossomos, com um interesse crescente em sua aplicabilidade em terapêuticas, evidenciado por mais de três mil publicações anuais sobre o tema e investimentos consideráveis em empresas emergentes focadas em exossomos.
Potencial Terapêutico dos Exossomos de Células Mesenquimais
Os exossomos derivados de células mesenquimais ou estromais (MSC) são destacados pelo seu potencial terapêutico, principalmente devido à capacidade dessas vesículas em mediar efeitos parácrinos, que são parte significativa das ações terapêuticas das células-tronco. Os exossomos de MSC, por sua segurança e potencial de serem produzidos em massa como produtos prontos para uso, emergem como alternativas promissoras aos tratamentos com células-tronco, evitando problemas como o potencial tumorigênico. Esses exossomos têm sido aplicados em uma ampla gama de modelos de doenças, incluindo neurologia, cardiovasculares, imunológicas, renais, músculo-esqueléticas, hepáticas, respiratórias, oftalmológicas e dermatológicas, além de cânceres.
Fontes e Potencial das Células Mesenquimais
As células mesenquimais ou estromais (MSCs) possuem a capacidade de auto-renovação e diferenciação em diversos tipos celulares, como adipócitos, condroblastos, osteoblastos e miócitos. Elas podem ser extraídas de várias fontes, incluindo tecido adiposo, medula óssea, polpa dentária, líquido sinovial, fluido amniótico, placenta, cordão umbilical, sangue do cordão umbilical e a geleia de Wharton. Além disso, as MSCs possuem propriedades imunomoduladoras, regulando células envolvidas na resposta imune, o que as torna terapias celulares promissoras para diversas doenças.
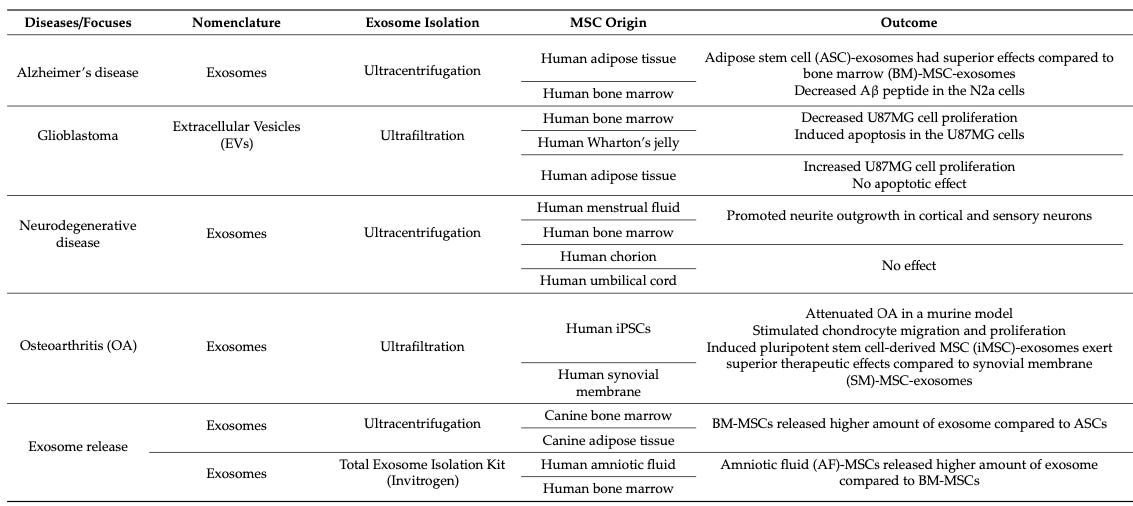
Os exossomos derivados de MSCs mostram variações nas suas características e funcionalidades dependendo da origem das MSCs. Por exemplo, exossomos de MSCs do tecido adiposo humano têm maior atividade de neprilisina, uma enzima que degrada peptídeos beta-amiloide no cérebro, sugerindo sua relevância terapêutica na doença de Alzheimer. Em contraste, exossomos de MSCs da medula óssea e da geleia de Wharton inibiram a proliferação celular e induziram apoptose em células de glioblastoma, enquanto os de tecido adiposo aumentaram a proliferação celular sem efeitos apoptóticos.
Meeting HOF Expert
A seleção adequada da fonte de MSCs é essencial para tratamentos específicos, como doenças neurodegenerativas, onde exossomos de MSCs do fluido menstrual e da medula óssea promoveram o crescimento de neuritos. Adicionalmente, exossomos de MSCs derivados de células-tronco pluripotentes induzidas e de membrana sinovial mostraram reduzir osteoartrite em modelos murinos, com exossomos de células pluripotentes exibindo um efeito terapêutico superior.
A comparação direta dos estudos sobre exossomos de MSCs é complicada devido às diferenças nos processos de isolamento, caracterização e avaliação de eficácia, além das variações devido aos diferentes doadores ou métodos de preparação das MSCs. Essas variáveis destacam a importância de considerar as diferenças biológicas, como a origem das MSCs e a eficácia dos seus exossomos, para aplicações clínicas específicas.
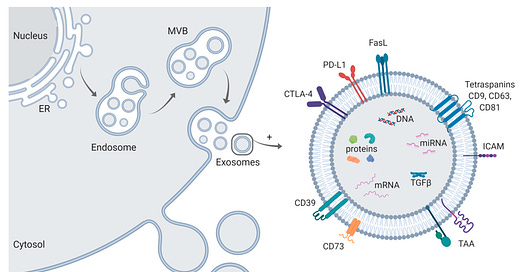
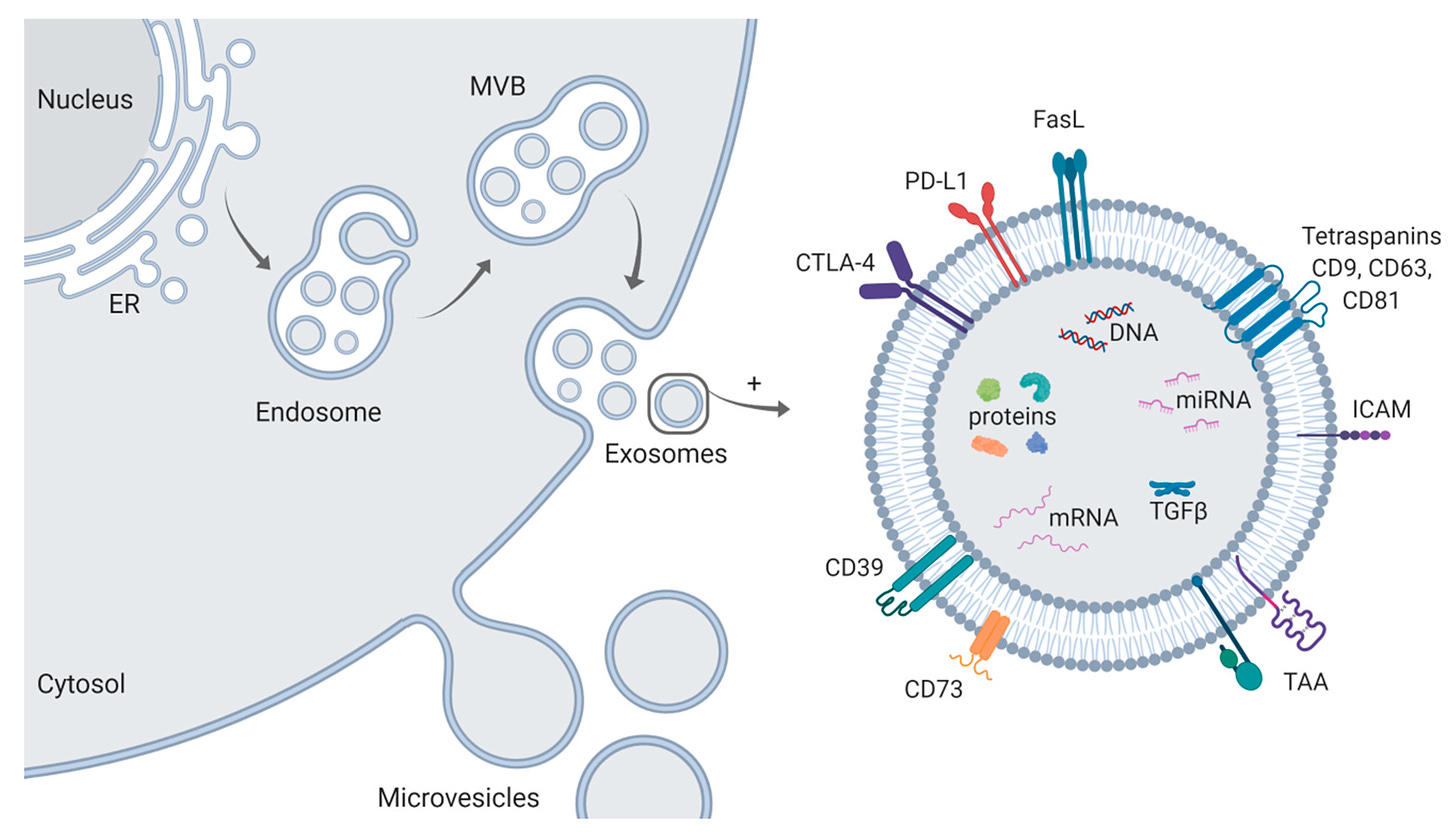
Controle de Qualidade na Produção de Vesículas Extracelulares para Terapia
A fabricação de vesículas extracelulares (VEs) com qualidade clínica exige um processo compatível com as boas práticas de fabricação (BPF) e um controle de qualidade (CQ) rigoroso. Isso é essencial não só para a produção terapêutica baseada em VEs, mas também para a reprodutibilidade dos estudos acadêmicos. Recentemente, diretrizes como as da Sociedade Internacional para Vesículas Extracelulares (MISEV2018) e as do Ministério da Alimentação e Segurança de Medicamentos da Coreia foram publicadas para padronizar este processo.
Para a quantificação de VEs, recomendam-se métodos como a análise de nanopartículas por rastreamento (NTA) e a dispersão dinâmica de luz (DLS). Esses métodos ajudam a determinar a quantidade e o tamanho das VEs, mas enfrentam desafios como baixa resolução em amostras polidispersas e dificuldades em diferenciar VEs de outras nanopartículas. Novas tecnologias, como a citometria de fluxo nano e a microscopia óptica de reconstrução estocástica direta, estão sendo desenvolvidas para melhorar a quantificação.
Para o controle da identidade das VEs, são recomendados marcadores específicos como os tetraspaninas (CD9, CD63 e CD81) e proteínas como Alix e TSG101, que são enriquecidos em exossomos e essenciais para confirmar a origem endocítica dos mesmos. Métodos como ELISA e análise citométrica são adequados para a detecção dessas proteínas em ambientes compatíveis com BPF.
A pureza é um critério crucial de CQ, monitorada através das razões partícula-proteína, proteína-lípido ou RNA-partícula. A ausência de proteínas intracelulares, como histonas e GRP94, é fundamental para confirmar a pureza dos exossomos. Impurezas provenientes do processo de cultura celular também devem ser analisadas para garantir a remoção de substâncias potencialmente perigosas.
Os ensaios de potência são fundamentais para prever a eficácia das VEs in vivo e são recomendados por autoridades reguladoras como a FDA. Estes ensaios ajudam a monitorar a consistência entre lotes e a determinar a dosagem adequada das VEs. No entanto, devido à complexidade do carregamento biológico das VEs, é desafiador estabelecer ensaios de potência que representem adequadamente o mecanismo de ação.
A implementação de controles rigorosos e a padronização dos métodos são essenciais para o avanço das terapias baseadas em vesículas extracelulares, garantindo a segurança, eficácia e reprodutibilidade necessárias para aplicações clínicas.
Anti-Inflamação e Imunomodulação por Exossomos
Os exossomos derivados de células mesenquimais (MSC) desempenham um papel crucial na modulação da resposta inflamatória e imunológica. Evidências crescentes indicam que esses exossomos promovem a polarização de macrófagos do fenótipo M1, associado a respostas pró-inflamatórias, para o fenótipo M2, que é caracterizado pela secreção de fatores anti-inflamatórios como IL-10 e TGF-β. Estudos demonstram que exossomos de MSC do tecido ósseo humano e da medula do maxilar promovem a cicatrização de feridas cutâneas e a melhoria da displasia broncopulmonar através da polarização M2 dos macrófagos.
Os exossomos de MSC contêm microRNAs específicos, como miR-223 e let-7b, que desempenham papéis importantes na regulação da polarização macrofágica. O miR-223 pode reduzir a inflamação e acelerar a cicatrização de feridas ao induzir a polarização M2 em macrófagos, enquanto o let-7b modula negativamente proteínas como TLR4 e NF-κB, que são cruciais na ativação das vias inflamatórias. Além disso, foi observado que os exossomos de MSC do cordão umbilical, especialmente após pré-condicionamento com LPS, contêm níveis elevados de let-7b, melhorando significativamente a cicatrização de feridas diabéticas.
Os exossomos de MSC têm sido aplicados em diversos modelos de doenças inflamatórias, incluindo aterosclerose, isquemia-reperfusão miocárdica e infarto do miocárdio, onde promovem a polarização de macrófagos para o fenótipo M2 e a secreção de citocinas anti-inflamatórias como IL-10. Essa modulação macrofágica é crucial para reduzir a inflamação sistêmica e local, oferecendo um método potencialmente eficaz e seguro para o tratamento de doenças crônicas e condições inflamatórias agudas.
Os exossomos de MSC, ao promoverem a polarização M2 dos macrófagos, também induzem a proliferação de células MSC e a produção de lactato, o que pode contribuir para a conversão de tecido adiposo branco em bege em modelos de obesidade. Essas descobertas sublinham o papel dos exossomos de MSC como moduladores eficazes da inflamação e da resposta imune, abrindo caminhos para novas abordagens terapêuticas em diversas condições inflamatórias e metabólicas.
Regulação de Células T por Exossomos de MSC
Os exossomos derivados de células mesenquimais (MSC) influenciam significativamente as funções e atividades das células T, modulando respostas imunes específicas. Exossomos de MSC da medula óssea foram relatados por converter células T auxiliares tipo 1 (Th1) em Th2 e reduzir a diferenciação de células Th17 em células mononucleares do sangue periférico (PBMCs). Além disso, esses exossomos aumentam os níveis de células T reguladoras (Tregs), possivelmente através da supressão de citocinas pró-inflamatórias como TNF-α e IL-1β e do aumento da citocina anti-inflamatória TGF-β.
Os mecanismos de regulação das células T por exossomos de MSC envolvem, em alguns casos, células apresentadoras de antígenos (APC), mas não diretamente células T CD4+. Este fenômeno sugere uma via indireta de modulação, onde as APCs ativadas são essenciais na mediação da diferenciação das Tregs, conforme induzido por exossomos de MSC de células-tronco embrionárias em um mecanismo dependente de MYD88.
Os exossomos de MSC demonstraram capacidade de modulação imune em vários modelos de doenças inflamatórias. Por exemplo, foram relatados efeitos benéficos em modelos de esclerose múltipla, lesão hepática induzida por concanavalina A, e lesão renal isquêmica-reperfusão, onde a polarização para fenótipos de macrófagos M2 e o aumento na população de Tregs foram observados. Estudos adicionais indicaram que os exossomos de MSC reduzem a proliferação de linfócitos T e B ativados, destacando seu papel potencial em condições autoimunes e inflamatórias.
No contexto de doenças cutâneas, como o envelhecimento da pele induzido por fotoenvelhecimento e a dermatite atópica, os exossomos de MSC provaram ser eficazes ao reduzir a inflamação e melhorar a regeneração da pele. Eles atuam diminuindo a expressão de múltiplas citocinas inflamatórias e reduzindo a infiltração de células dendríticas inflamatórias na pele lesada.
Embora os exossomos de MSC compartilhem propriedades anti-inflamatórias e imunomoduladoras com as células MSC originais, eles também podem possuir mecanismos imunomoduladores distintos, que precisam ser mais explorados para facilitar sua aplicação em ambientes clínicos. A diferenciação de Tregs mediada pelos exossomos de MSC, por exemplo, pode contribuir significativamente para a supressão de doenças como a doença do enxerto contra o hospedeiro, onde os exossomos de MSC foram usados pela primeira vez em uma aplicação clínica alógena. A continuação das pesquisas é crucial para entender melhor a composição e o modo de ação dos exossomos, visando otimizar suas aplicações terapêuticas para diversas doenças inflamatórias e autoimunes, além da regeneração cutânea.
Efeitos Antienvelhecimento dos Exossomos
A senescência celular é identificada como um dos principais marcadores do envelhecimento, caracterizada por uma parada irreversível no ciclo celular e uma resposta inflamatória conhecida como fenótipo secretório associado à senescência (SASP). A SASP modifica o microambiente celular e contribui para a "inflamação", uma inflamação crônica de baixo grau associada ao envelhecimento. A acumulação de células senescentes e os componentes da SASP são ligados a diversas doenças relacionadas à idade.
Os exossomos, uma forma de vesículas extracelulares (EVs), podem tanto transferir quanto aliviar características de senescência celular, dependendo de suas células de origem. Eles são considerados novos componentes do SASP e marcadores de doenças relacionadas à idade. Alterações relacionadas à idade nos EVs incluem variações no número liberado, composição e função, influenciando doenças como aterosclerose e diabetes tipo 2. Essas vesículas podem mediar a senescência parácrina, transmitindo características de senescência de células senescentes ou doentes para células normais.
Pesquisas recentes revelam que os exossomos derivados de células jovens ou de células-tronco podem ter efeitos rejuvenescedores em organismos mais velhos. Exossomos do plasma de camundongos jovens foram mostrados para estender a vida útil de camundongos mais velhos, atrasando o envelhecimento através de mecanismos que incluem a transferência de nicotinamida fosforribosiltransferase exossomal (eNAMPT). Outros estudos destacaram a capacidade de exossomos jovens de reverter a expressão de moléculas associadas ao envelhecimento e rejuvenescer a imunotolerância das células T em camundongos mais velhos.
Exossomos derivados de células-tronco adultas (ASC) demonstraram reduzir a senescência prematura de células progenitoras endoteliais induzida por alta glicose e melhorar a cicatrização de feridas em ratos diabéticos. Estudos indicam que o RNA longo não codificante (lncRNA) MALAT1, presente nos exossomos de ASC, pode recuperar funções de comportamento motor e reduzir lesões cerebrais corticais em modelos de lesão cerebral traumática em ratos. Além disso, enzimas antioxidantes, como as peroxirredoxinas (PRDXs), são abundantes em exossomos de células-tronco e podem aliviar fenótipos de envelhecimento celular.
Potencial dos Exossomos na Modulação do Envelhecimento
Os exossomos têm mostrado potencial não apenas para mitigar características senescentes em células-alvo, mas também para influenciar condições patológicas associadas ao envelhecimento, como osteoartrite e estresse oxidativo. Estes achados sugerem que os exossomos podem ser agentes terapêuticos promissores no tratamento de doenças relacionadas ao envelhecimento e na promoção da saúde e longevidade.